CONFIGURACIÓN ELECTRÓNICA
La configuración electrónica expresa la distribución de los electrones
en la nube electrónica, indicando los niveles, subniveles y orbitales para
escribir las configuraciones electrónicas se siguen tres reglas:
- El principio de mínima energía
- El principio de exclusión de Pauli
- La regla de Hund
PRINCIPIO DE MÍNIMA ENERGÍA.- Establece que los electrones van llenando
primero orbitales de menor energía, es decir, los que están más cerca del
núcleo.
El orden del llenado de electrones puede recordarse fácilmente usando
un esquema mnemotécnico conocido como regla del serrucho o diagrama de Moeller.
Frase célebre
Si
Soy peruano, soy peruano,
Soy del Perú, soy del Perú,
Soy futuro del Perú, soy futuro del Perú.
Alineación de la configuración
1s 2s…
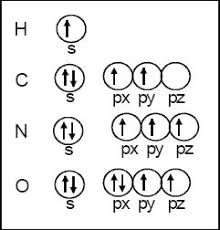
Ejemplos:
Desarrolla las siguientes configuraciones electrónicas de los
siguientes elementos químicos: Na, S, B, H, N
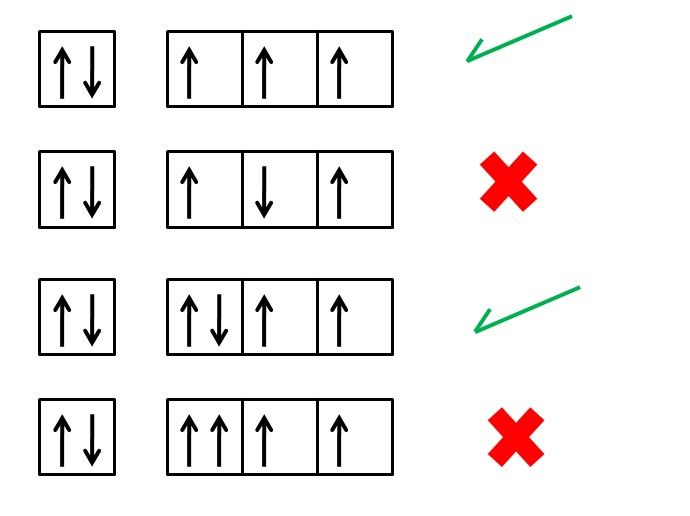
REGLA DE HUND
Llamada también regla de máxima multiplicidad. Establece lo siguiente: al distribuir los electrones en orbitales de un mismo subnivel, éstos ocuparán primero el máximo número de orbitales (entrando en ellos con el mismo spin) es decir, no podrán formar pares (aparearse) hasta que todos los orbitales tengan por lo menos un electrón.
Ejemplo:
 |
Añadir título
|
 |
Añadir título
|
 |
Añadir título
|
Actividad.- Desarrolla los siguientes ejercicios: He, Ne, Mg, Si, Cl, Ca.
PRINCIPIO DE EXCLUSIÓN DE PAULI
En un átomo no pueden existir dos electrones con sus cuatro números cuánticos iguales, al menos deben diferenciarse en el spin. Así, por ejemplo, tenemos la posición de los electrones de dos elementos X:

|
|
Analizando la posición de electrones de los elementos X, concluimos que ambos electrones se encuentran en el mismo nivel de energía (n=5) en el mismo subnivel (l=1) y en el mismo orbital (m=-1), pero se diferencian porque tienen spin opuesto, es decir: S = +1/2, -1/2; por consiguiente, X1 es diferente a X2.
Ejemplo: Realiza la distribución electrónica del nitrógeno, sabiendo que Z=7. Aplicando las diferentes reglas y principios atómicos. Determina:
a. El número de niveles
b. El número de electrones en cada capa.
c. El número de subniveles
d. Número de electrones en cada subnivel.
e. Número de orbitales.
f. Aplica la regla del serrucho.
g. Realiza la distribución por orbitales.
h. Aplica la regla de Hund.
i. Número de electrones apareados y desapareados.
j. Determina los números cuánticos de dicho elemento.
REGLAS PARA LA DISTRIBUCIÓN ELECTRÓNICA SEGÚN BOHR Y BURY
a. El total de electrones alrededor del núcleo de un átomo es igual al número de protones o número atómico, Z.
b. El máximo de electrones en cada nivel de energía, viene dado por 2n2. Así 2 (12, 22, 32, 42, 42, 32, 22) es decir: K(2), L(8), M(18), N(32), O(32), P(18), Q(8).
c. El nivel externo no puede contener más de 8 electrones, así mismo, el penúltimo nivel de energía no puede contener más de 18 e-.
d. El último nivel de energía no puede contener más de 2 electrones si el penúltimo no ha alcanzado el máximo de electrones fijados en la regla "c".
e. El penúltimo nivel no puede contener más de 9 e- si es que el antepenúltimo nivel no ha alcanzado el número máximo de e- que le corresponden en la regla "b".
f. Cuando una distribución electrónica conduce a 17 - 2 en los últimos niveles, se cambia por 18 -1, así por ejemplo, se produce con los elementos: Cu, Ag, Au.
Ejemplo 1.- Realiza la distribución electrónica en niveles del elemento 30 (Z) y graficar su estructura electrónica.
a. Analizando el elemento 30, concluimos que tiene 4 niveles de energía, para lo cual llenamos los dos primeros niveles con el máximo de electrones.
1 2 3 4
K L M N
2 8
b. Aplicando la regla "d" para el llenado de electrones en los niveles restantes tenemos:
K L M N
2 8 18 2
(2 + 8 + 2 = 12; 30 - 12 = 18)
c. Gratificando la estructura electrónica de Z = 30 tenemos:
Ejemplo 2.- Sabiendo que Z = 38, realiza la distribución electrónica de dicho elemento y grafica su estructura electrónica.
Actividad.- Realiza la distribución electrónica en niveles del elemento Z = 15 y graficar su estructura electrónica.
EXCEPCIONES DE LA DISTRIBUCION ELECTRONICA
Las excepciones que se representan en la distribución electrónica de los elementos se relacionan generalmente con algunos metales de transición; así tenemos:
En algunos elementos tales como: Cromo (Cr), Cobre (Cu), Niobio (Nb), Molibdeno (Mo), Tecnecio (Tc), Rutenio (Ru), Paladio (Pd), Plata (Ag), Platino (Pt), Oro (Au), etc, no se cumple la regla de Moeller porque un electrón de la penúltima subcapa pasa a la última subcapa; en el caso del paladio pasan dos electrones.
Ejemplo:
- Distribución electrónica del elemento 24 (Cr):
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d4 ( I )
1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d5 ( C )
- Distribución electrónica del elemento 46 (Paladio) :
1s2, 2s2, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d8 ( I )
1s2, 2s2, 3s3, 3p6, 2s2, 3d10, 4p6, 5s0, 4d10 ( C )
I = Distribución incorrecta.
C = Distribución correcta.
En la distribución electrónica del lantano (La) en la que un electrón entra en el subnivel 5d en lugar de ocupar el subnivel 4f. Ejemplo:
57La = 6s2, 5d1
En forma análoga ocurre en el actinio, se colocó un electrón en el subnivel 6d antes que ocupe el subnivel 5f. Ejemplo:
89Ac = 7s2, 6d1
Desarrollar la configuración electrónica de Cu, Mo, Ag, Au.




No hay comentarios:
Publicar un comentario